|
Was
ist Plutonium?
Plutonium
ist physikalisch-chemisch gesehen ein Element mit der Kernladungszahl
94 und gehört zu den Actiniden. Es ist ein Schwermetall und
deshalb auch so giftig wie die meisten Schwermetalle. Seine
chemische Toxizität (ohne seine Radioaktivität!) ist der von
Barium oder Beryllium ähnlich, Elementen, die in vielen Labors
und im technischen Alltag gebräuchlich sind.
Kernphysikalisch
sind die meisten Pu-Isotope relativ langlebige Atomkerne,
die unter Emission von a-Teilchen
(Heliumkernen) in Uran zerfallen (Ausnahme nur das 241Pu,
was sich unter b--Zerfall
in 241Am wandelt). Das gebräuchlichste Isotop 239Pu
zerfällt mit einer Halbwertszeit von 24110 Jahren unter Aussendung
von a-Teilchen von 5,096 - 5,157
MeV in 235U. Seine spezifische Aktivität beträgt
2000 Bq/µg, also 2000 Bq pro einem Millionstel Gramm. (1 m
sind 1/1.000.000).
Plutonium
kommt in der Natur vor und wird durch natürliche Prozesse
(natürliche Kernreaktionen mit der Höhenstrahlung) in Uran
ständig gebildet. Auch wenn große Mengen durch Menschenhand
geschaffen wurden, gibt es immerhin rd. 300 Tonnen natürliches
Plutonium im Erdboden über den Planeten verteilt, das durch
diesen natürlichen Prozess erzeugt wurde. Diese relativ große
Menge ist aber eben über die ganze Erde verteilt, und deshalb
kaum nachweisbar. 1971 berichteten amerikanische Wissenschaftler
[Darlenne Hoffman, Nature 234, 132 (1971)] - vom erfolgreichen
Nachweis geringster Mengen des langlebigsten Plutoniumsiotops
Pu-244 (Halbwertszeit 8,26*107 Jahre) in einem
kalifornischen Erz. Dieses Plutonium stammt aus der Zeit der
Elemententstehung in unserem Sonnensystem (wurde also natürlich
gebildet, wie alle anderen Elemente auch). Weiterhin wurden
1972 in Oklo/Gabun geringe Mengen von 239Pu entdeckt.
In diesem prähistorischen natürlichen Kernreaktor wurden vor
etwa 2 Milliarden Jahren durch Einfang von Neutronen, die
aus der Spaltung von 235U und aus der Spontanspaltung
des 238U entstehen, mindestens eine Tonne Plutonium
gebildet. Dieses Plutonium ist bis heute fast völlig radioaktiv
zerfallen. (siehe Oklo
- Kernreaktoren und nukleare Endlager: keine Erfindung des
Menschen)
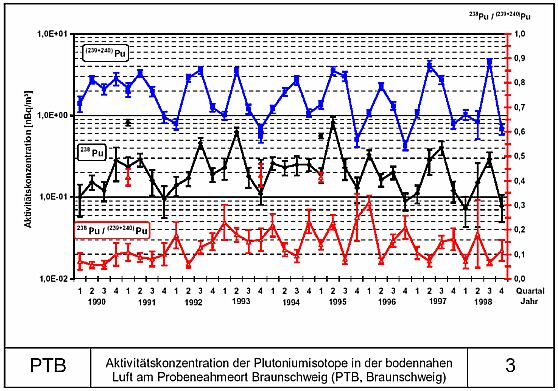
Das
Plutonium, welches man heute sehr leicht mit empfindlichster
moderner Analysentechnik überall in der Umwelt nachweisen
kann, stammt aber aus oberirdischen Kernwaffenversuchen aus
der Zeit des kalten Krieges, und von Abstürzen zumeist militärischer
Satelliten mit Plutonium-Batterien.
Freisetzung
von Plutonium
In
der Zeit von Juli 1945 bis Oktober 1980 wurden 423 oberirdische
Kernwaffenversuche durchgeführt. Die dabei freigesetzte Plutoniummenge
wird weltweit auf 3 bis 5 t (ca. 1016 Bq) geschätzt
[W. Koelzer, Plutonium, KfK-Bericht 4516, Kernforschungszentrum
Karlsruhe, März 1989]. Bis heute sind zwei schwere Unfälle
mit plutoniumhaltigen Bomben bekannt geworden, wobei es nicht
zu einer Atomwaffenexplosion kam, jedoch wurde Plutonium in
einer Menge von einigen kg freigesetzt. Die betroffenen Böden
wurden abgetragen und in Fässer verpackt. Allerdings werden
die Restkontaminationen der kontaminierten Flächen auf 30
g bzw. 400 g Plutonium abgeschätzt [C. Keller, Chemiker-Zeitung
103, 139 (1979)]. Auch beim Absturz von Satelliten, die mit
238PuO2-Isotopenbatterie ausgestattet
waren, wurde 238Pu freigesetzt. Aus den Atomwaffenlaboratorien
wurden g-Mengen von Plutonium durch Unfälle freigesetzt.
Der
bisher schwerste Kernreaktorunfall ereignete sich am 26. April
1986 in Tschernobyl. Der größte Teil des Plutoniums verblieb
- im Gegensatz zu den Spaltprodukten wie Cäsium und Strontium
- wegen der geringen Flüchtigkeit entweder im Reaktor selbst
oder in der näheren Umgebung des Unfallortes.
Durch
die Wiederaufarbeitungsanlage in Sellafield / Großbritannien
wurden lokal bis zu 1,5 * 1013 Bq Gesamt-a-Aktivität
in die Irische See geleitet, wovon sich 90 % des Plutoniums
in den Seesedimenten abgelagert hat. [W. Koelzer, Plutonium,
KfK-Bericht 4516, Kernforschungszentrum Karlsruhe, März 1989]
Verhalten
von Plutonium in der Umwelt
Der
Transport auf der Erdoberfläche erfolgt fast ausschließlich
durch Resuspension, da die Beweglichkeit (Mobilität) des Plutoniums
im Boden außergewöhnlich niedrig ist. Bei Untersuchungen über
das Tiefenprofil des Fallout-Plutoniums ergab sich für Stellen,
die mindestens 15 Jahre ungestört waren, daß sich in Schichttiefen
unterhalb 30 cm weniger als 5 % des Gesamtplutoniums befinden
[Hardy, Nucl.Sci.Abstr. 26(10), 1972].
Die
langsame Wanderung ist von der Chemie des Plutoniums her verständlich.
Das vierwertige Plutonium hydrolysiert und bildet Polymere.
Diese werden von Bodenbestandteilen aufgenommen und sind praktisch
kaum desorbierbar. Hier besteht eine Abhängigkeit von der
Bodenstruktur wobei auch der pH-Wert des Bodens bestimmend
ist. Die Menge und Art an Tonmineralien wirkt sich in zweifacher
Form aus: als mechanischer Filter und als Ionentauscher. Im
Wasser befinden sich nur ein Tausendstel des Plutoniums wie
im darunterliegenden Boden. Es wird daher schlecht abtransportiert
und somit nur langsam von Pflanzenwurzeln aufgenommen. In
Gewässern erfolgt fast ausschließlich Sedimentation. Es sind
einige Algen und Muscheln bekannt, die vierwertiges Plutonium
anreichern und deshalb als Bioindikatoren für dieses Element
dienen.
Plutonium
im Menschen
Die
Ingestion trägt wenig (etwa 0,1 %) zur Plutonium-Kontamination
der Bevölkerung bei, die Hauptaufnahme erfolgt über Inhalation.
Für die Anlagerung des inhalierten, mit Plutoniumdioxid (PuO2)
beladenen Aerosols ist im Atmungstrakt die Teilchengröße mitbestimmend.
Bei relativ feinkörnigen Aerosolen (von 0,1 µm) erreichen
etwa 30 % der Aktivität die Lunge, bei 1 µm nur noch 0,03%.
Der Aktivitätstransfer zwischen dem Atmungstrakt und der Körperflüssigkeit
hängt in komplizierter Weise von der physikalisch-chemischen
Beschaffenheit des inhalierten Aerosols ab. Von der in die
Körperflüssigkeiten transferierten Plutoniumaktivität werden
50 % im Skelett und 30 % in der Leber abgelagert. Der Rest
wird sofort wieder ausgeschieden. Die biologischen Halbwertszeiten
betragen im Skelett 50 und in der Leber 20 Jahre [Gesellschaft
für Strahlenschutz- und Umweltforschung München, Plutonium,
Mensch und Umwelt, 1989]. Eine biochemische, toxische Wirkung
des Plutoniums wird erst bei hohen Konzentrationen (LD50
(intravenös) = 1 mg 239Pu / kg Körpergewicht kleiner
Nagetiere) im Blut beobachtet. Die Letaldosis beim Menschen
beträgt durch Inhalation 0,05 g 239Pu, das
sind immerhin 100 Millionen Bq. (Zum Vergleich: die folgende
Tabelle! Dioxin - bekannt aus den Medien ist
also viel viel giftiger!))
|
Substanz
|
LD50
|
Verabreichung
|
|
Ethanol
|
10
000
|
Injektion
|
|
Morphin
|
900
|
Injektion
|
|
Nikotin
|
1
|
Injektion
|
|
Plutonium-239
|
1
|
Injektion
|
|
Plutonium-239
|
2
|
Inhalation
|
|
Tetradotoxin
|
0,1
|
Injektion
|
|
Dioxin
|
0,001
|
Injektion
|
|
Botolinustoxin
|
0,00001
|
Injektion
|
Die
Tabelle gibt die LD50-Werte für verschiedene Gifte an, sie gibt
die Menge eines Giftes in Milligramm je Kilogramm Körpergewicht
an, bei der 50 Prozent der Versuchstiere nicht überleben.
Plutonium
wird vom Transferrin gebunden, das für den Eisentransport
zuständig ist. Unter der radiotoxischen Wirkung versteht man
die Schädigung der Zellen durch die ionisierende -Strahlung,
was zum Zelltod führen kann. Als Spätschäden treten Lungenkrebs
und Leukämie auf, da es durch die Ionisierung der a-Teilchen
an der DNS zu irreparablen Genveränderungen kommen kann.
Was
bedeutet das für den Umgang mit Plutonium?
 Die
Abbildungen zeigen einige Verbindungen des vierwertigen Plutoniums
in Lösungen: Hier zeigt sich die Farbenvielfalt der verschiedenen
Oxidationsstufen des Plutoniums. Die
Abbildungen zeigen einige Verbindungen des vierwertigen Plutoniums
in Lösungen: Hier zeigt sich die Farbenvielfalt der verschiedenen
Oxidationsstufen des Plutoniums.
[Foto:
Los Alamos National Laboratory, USA]
Die
Strahlung des Plutoniums reicht in der Luft nur einige Zentimeter
weit und wird zum Beispiel schon von einem Blatt Papier oder
von Stoffhandschuhen vollständig zurückgehalten.
Der
Kreis von Personen, die beruflich mit Plutonium zu tun haben
(etwa in Forschungszentren), wird besonders sorgfältigen Kontrollen
und Schutzvorkehrungen unterzogen.
So
befindet sich das Plutonium während der gesamten Bearbeitung
immer in einsehbaren, abgeschlossenen Behältnissen, in dem
der Mitarbeiter durch Fernhantierung oder fest installierte
Gummihandschuhe (Handschuhkasten, Foto folgt) sicher und ohne
jeden direkten Kontakt mit dem Stoff arbeiten kann. zudem
gibt es ein getrenntes Lüftungssystem mit Unterdruck, so daß
keine Luft aus dem Behältnis in die Atemluft eindringen kann.
Möglichkeiten
des Nachweises
Für
die umweltrelevanten Plutoniumisotope dominiert der a-Zerfall.
Nachweisen kann man deshalb Plutonium durch a-Spektrometrie,
einer gängigen radiochemischen Analysenmethode. Weitere spurenanalytische
Verfahren sind verschiedene Methoden der Massenspektroskopie,
wobei die Resonanz-Ionisationsmassenspektroskopie (RIMS) heute
mit Nachweisgrenzen von 106 Atomen die erfolgreichste
darstellt.
Als
weitere Bestimmungsverfahren für 239Pu seien noch
die Messung b-verzögerter
Neutronen nach neutroneninduzierter Spaltung und die Spaltspurmethode
erwähnt. Die a-Spektroskopie
ist um 3 Größenordnungen unempfindlicher, weil sie durch die
lange Halbwertszeit von 239Pu beschränkt ist. Die
Messung der b-verzögerten
Neutronen ist für Routineuntersuchungen (hohe Anzahl von Proben)
zu empfehlen.
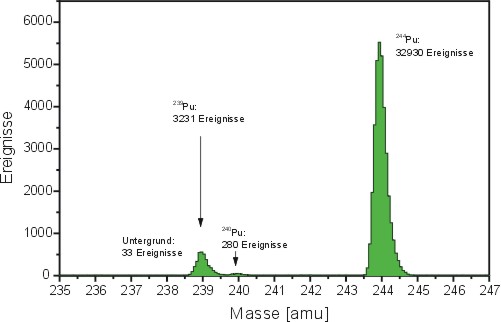
Abb.:
RIMS-Spektrum von Plutonium einer “normalen” Meerwasserprobe
mit 33 mBq/m3 239Pu (244Pu
ist als bekannte Konzentration zur Bestimmung der chemischen
Ausbeute - “Spike” - zugesetzt)
Die
Abbildung zeigt ein RIMS-Spektrum mit Plutonium-Isotopen aus
einer Meerwasserprobe. Neben dem großen Signalpeak für das
Isotop 244, was der Analytiker zur Bestimmung selbst zusetzt
(also in der Umweltprobe nicht vorhanden ist) zeigt sich vorrangig
das Plutoniumisotop 239 und wenig mit der Massenzahl 240.
Die Probe ist also Plutonium, wie es aus Atombombentests freigesetzt
wird. Da Reaktorplutonium eine völlig andere Isotopensignatur
zeigen würde, kann man sehr genau auf die Herkunft von Plutoniumkontaminationen
schließen.
Kommentar
zum Nutzen
Über
den Nutzen von Plutonium kann man trefflich streiten. Für
einen nüchternen Naturwissenschaftler gibt es dabei nur zwei
Fakten. Plutonium entsteht bei der Nutzung der Kernenergie,
wenn man dafür Uran einsetzt (anders ist das bei Thorium),
da Uran zum wesentlichen Teil aus dem Isotop mit der Massenzahl
238 besteht. Der sichere Umgang mit diesem Stoff ist demonstriert
wurden und die Gefährlichkeit ist nicht größer, als bei manch
anderen chemischen Giftstoffen. Da Plutonium nun einmal anfällt,
kann man es im Sinne einer Ressourcenschonung sinnvoll zur
Energiegewinnung wieder einsetzen, anstatt es in der Erde
zu vergraben. Die Ressourcenschonung wird für die Zukunft
unseres Planeten noch eine bedeutende Rolle spielen.
Weitere
Informationen
-
Link
zur Gefahr von Plutonium (englischsprachige Seite des
Lawrence Livermore National Laboratory (LLNL))
-
Link
zu einer eigenen Seite über die Chemie und Physik des
Plutoniums auf
www.kernchemie.de
 Lesen
Sie auch über Plutonium-Batterien Lesen
Sie auch über Plutonium-Batterien
100
Watt Pu-238 Quelle, wie sie in einer Raumfahrtmission 1970
verwendet worden ist. Die Quelle ist 250g schwer und ungefähr
3 cm im Durchmesser.
[Foto:
Los Alamos National Laboratory, U.S.A]
|